Kiểm tra giữa kì I môn Hoá học 10 - Trường THPT Nghèn
Phần I : Trắc nghiệm (8đ)
Câu 1: Nguyên tử nào sau đây có cấu hình electron là 1s22s22p63s2?
A. Mg (Z=12). B. Na (Z=11). C. Al (Z=13). D. Si (Z=4).
Câu 2: Trong nguyên tử, loại hạt nào có khối lượng không đáng kể so với các hạt còn lại?
A. nơtron. B. nơtron và electron. C. electron. D. proton.
Câu 3: Nguyên tố X thuộc nhóm IIIA. Số electron lớp ngoài của nguyên tử X là
A. 5. B. 4. C. 3. D. 2.
Câu 4: Nguyên tố nào sau đây có độ âm điện lớn nhất?
A. O. B. S. C. Na. D. F.
Câu 5: Nguyên tố X thuộc chu kì 5. Số lớp electron của nguyên tử X là
A. 5. B. 2. C. 4. D. 3.
Câu 6: M là nguyên tố nhóm IA, oxit của nó có công thức là
A. MO2. B. MO. C. M2O3. D. M2O.
Câu 7: Nguyên tử được cấu tạo bởi bao nhiêu loại hạt cơ bản?
A. 4. B. 1. C. 3. D. 2.
Câu 8: Số proton và số nơtron có trong một nguyên tử nhôm ( ) lần lượt là
A.13 và 13. B. 13 và 14. C. 12 và 14. D. 13 và 15.
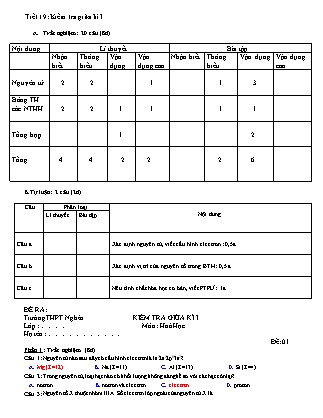
Tiết 19: Kiểm tra giữa kì I Trắc nghiệm: 20 câu (8đ) Nội dung Lí thuyết Bài tập Nhận biết Thông hiểu Vận dụng Vận dụng cao Nhận biết Thông hiểu Vận dụng Vận dụng cao Nguyên tử 2 2 1 1 3 Bảng TH các NTHH 2 2 1 1 1 1 Tổng hợp 1 2 Tổng 4 4 2 2 2 6 B.Tự luận: 2 câu (2đ) Câu Phân loại Nội dung Lí thuyết Bài tập Câu a. Xác định nguyên tử, viết cấu hình electron : 0,5đ Câu b. Xác định vị trí của nguyên tố trong BTH: 0,5 đ Câu c. Nêu tính chất hóa học cơ bản, viết PTPƯ: 1đ ĐỀ RA: Trường THPT Nghèn KIỂM TRA GIỮA KÌ I Lớp : Môn : Hoá Học Họ tên : Đề: 01 Phần I : Trắc nghiệm (8đ) Câu 1: Nguyên tử nào sau đây có cấu hình electron là 1s22s22p63s2? A. Mg (Z=12). B. Na (Z=11). C. Al (Z=13). D. Si (Z=4). Câu 2: Trong nguyên tử, loại hạt nào có khối lượng không đáng kể so với các hạt còn lại? A. nơtron. B. nơtron và electron. C. electron. D. proton. Câu 3: Nguyên tố X thuộc nhóm IIIA. Số electron lớp ngoài của nguyên tử X là A. 5. B. 4. C. 3. D. 2. Câu 4: Nguyên tố nào sau đây có độ âm điện lớn nhất? A. O. B. S. C. Na. D. F. Câu 5: Nguyên tố X thuộc chu kì 5. Số lớp electron của nguyên tử X là A. 5. B. 2. C. 4. D. 3. Câu 6: M là nguyên tố nhóm IA, oxit của nó có công thức là A. MO2. B. MO. C. M2O3. D. M2O. Câu 7: Nguyên tử được cấu tạo bởi bao nhiêu loại hạt cơ bản? A. 4. B. 1. C. 3. D. 2. Câu 8: Số proton và số nơtron có trong một nguyên tử nhôm () lần lượt là A.13 và 13. B. 13 và 14. C. 12 và 14. D. 13 và 15. Câu 9: Khẳng định nào sau đây đúng? A. Nguyên tử S (Z=16) là nguyên tố p. B. Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng đều là kim loại. C. Các nguyên tử khí hiếm đều có 8 electron ở lớp ngoài cùng. D. Các nguyên tử đều có số nơtron lớn hơn số proton. Câu 10: Điện tích của 1 proton có điện tích bằng 1,602.10-19 culông. Hạt nhân của nguyên tử X có điện tích là 30,4.10-19 culông. Vậy nguyên tử X là A. K (Z=19). B. Ar (Z=18). C. Ca (Z=20). D. Cl (Z=17). Câu 11: Nguyên tử X có tổng số hạt p, n, e là 52 và số khối là 35. Số hiệu nguyên tử của X là A. 17 B. 18 C. 34 D.52 Câu 12: Trong bảng tuần hoàn, nguyên tố canxi (Ca) ở chu kì 4, nhóm IIA. Điều khẳng định nào sau đây về nguyên tử Ca là sai? A. Oxit và hiđroxit có khối lượng phân tử lần lượt là 56 và 74. B. Có 4 lớp electron và có 2 electron ngoài cùng. C. Trong các hiđroxit của kim loại nhóm IIA, Ca(OH)2 có tính bazơ mạnh nhất. D. Có xu hướng nhường 2 electron khi tham gia phản ứng hóa học. Câu 13: Tổng số hạt mang điện dương của hai nguyên tố X, Y đứng liên tiếp nhau trong cùng một chu kì là 31. Kí hiệu hóa học của X và Y lần lượt là A. Mg và K. B. Na và Ca. C. Si và Cl. D. P và S. Câu 14: Cho 7,8 gam kali tác dụng vừa đủ với O2, thu được m gam oxit. Giá trị của m là A. 9,4. B. 14,2. C. 7,1. D. 18,8. Câu 15: Sắp xếp các bazơ: Al(OH)3, Mg(OH)2, Ba(OH)2 theo độ mạnh tăng dần A. Al(OH)3<Mg(OH)2<Ba(OH)2. B. Mg(OH)2<Ba(OH)2<Al(OH)3. C. Al(OH)3<Ba(OH)2< Mg(OH)2. D. Ba(OH)2<Mg(OH)2<Al(OH)3. Câu 16: Nguyên tố X có hai đồng vị, đồng vị thứ nhất 35X chiếm 75%. Nguyên tử khối trung bình của X là 35,5. Đồng vị thứ hai là A. 38X. B. 37X. C. 34X. D. 36X. Câu 17: Biết hiđro có 3 đồng vị và oxi có 3 đồng vị . Số phân tử H2O tạo thành từ các đồng vị của nguyên tố H và O là A. 6. B. 18. C. 24. D. 12. Câu 18: Cho 12,8 gam hỗn hợp hai kim loại nhóm IIA, thuộc hai chu kỳ liên tiếp, tác dụng hết với dung dịch HCl dư, thu được 8,96 lít khí hiđro (đktc). Hai kim loại đó là A. Ca và Sr. B. Sr và Ba. C. Mg và Ca. D. Be và Mg. Câu 19: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có 1 electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là A. Khí hiếm và kim loại. B. Kim loại và kim loại. C. Kim loại và khí hiếm. D. Phi kim và kim loại. Câu 20: Cho 3 nguyên tố X, Y, T. Trong đó X, Y thuộc cùng chu kì. - Hợp chất XH3 có chứa 8,82% khối lượng hiđro. - X kết hợp với T tạo ra hợp chất X2T5, trong đó T chiếm 56,34% về khối lượng. - Y kết hợp với T tạo thành hợp chất YT2, trong đó Y chiếm 50% khối lượng. Xếp các nguyên tố X, Y, T theo chiều tăng tính phi kim là: A. X, Y, T. B. Y, X, T. C. Y, T, X. D. T , X, Y. Phần II: Tự luận (2 đ) Câu 21: Một nguyên tử R có tổng số hạt cơ bản (p,n,e) bằng 58, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 18 hạt. a.Viết cấu hình electron của nguyên tử R b.Xác định vị trí của R trong bảng HTTH. c.Nêu tính chất hóa học cơ bản của R.Viết phương trình phản ứng minh họa Đáp án tự luận: Câu 21: Theo bài ra ta có: 2P + N = 58 2P – N = 18 → P=19 . Vậy R là K Cấu hình e: 1s22s22p63s23p64s1 K ở ô thứ 19, chu kì 4( vì có 4 lớp e), nhóm IA ( Vì đây là nguyên tố s và có 1e ở lớp ngoài cùng) Tính chất hóa học cơ bản của K: Do có 1e ở lwps ngoài cùng nên nguyên tử K dễ mất 1e→ K thể hiện tính kim loại mạnh -Tác dụng với phi kim: 2K + Cl2 → 2KCl -Tác dụng với H2O: K + H2O → KOH + ½ H2
Tài liệu đính kèm:
 kiem_tra_giua_ki_i_mon_hoa_hoc_10_truong_thpt_nghen.doc
kiem_tra_giua_ki_i_mon_hoa_hoc_10_truong_thpt_nghen.doc



